內(nèi)容來源:E藥經(jīng)理人
這個時(shí)代一直不變的就是一直在變,中國醫(yī)藥行業(yè)更是如此。近3年(2019.7.1-2022.7.1)醫(yī)藥生物(申萬分類)中各子行業(yè)的估值水平都表現(xiàn)出相似的變化趨勢,即不同程度的先升后降。這種趨勢的成因主要為新冠疫情和重大行業(yè)政策,若干突發(fā)的行業(yè)事件也起到了推波助瀾的作用。
在新冠疫情初期,醫(yī)藥行業(yè)作為與抗疫直接密切相關(guān)的行業(yè),吸引了社會的關(guān)注,受到了資本的追捧。醫(yī)藥子行業(yè)中與抗疫關(guān)聯(lián)最為緊密的生物制品、醫(yī)療器械的估值水平在2020年中期的增長尤其顯著,眾多企業(yè)的市值紛紛創(chuàng)造記錄。醫(yī)療服務(wù)(申萬分類)包括了To B的醫(yī)藥研發(fā)外包服務(wù)與To C的醫(yī)療服務(wù),在互聯(lián)網(wǎng)醫(yī)療、檢測、醫(yī)美、海外訂單等的接力推動下維持了較長時(shí)期的高估值。
圖表1. 醫(yī)藥生物(申萬分類)中各子行業(yè)近三年
的PE(TTM)變化趨勢(2019.7-2022.7)
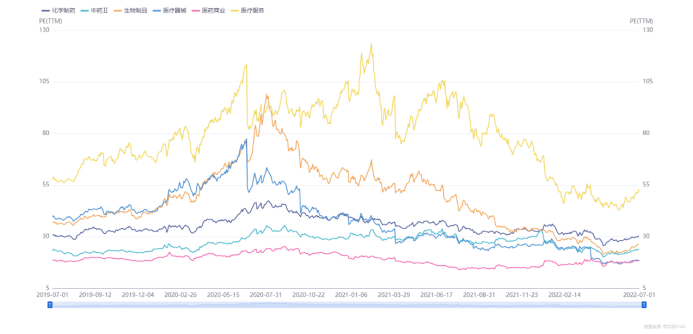
醫(yī)藥行業(yè)的估值水平回調(diào)始于2020年下半年,然而業(yè)界仍沉浸于疫情帶來的收益喜悅中難以自拔。在2021年上半年,除醫(yī)療器械行業(yè)估值水平因疫情緩和而下降較多外,醫(yī)藥工業(yè)中的生物制品和化學(xué)制藥行業(yè)的估值持續(xù)回調(diào)至與疫情之前的2019年下半年基本持平。業(yè)界將回調(diào)歸因于疫情利好出盡,保持良好平和心態(tài)。
面對疫情之下已然過熱、偏離高質(zhì)量發(fā)展路徑的醫(yī)藥行業(yè),政策層面從能夠代表行業(yè)創(chuàng)新水平、資本參與度較高的創(chuàng)新藥行業(yè)入手,適時(shí)引領(lǐng)行業(yè)走向高質(zhì)量發(fā)展的正確路徑。2021年7月2日,國家藥審中心(CDE)發(fā)布《以臨床價(jià)值為導(dǎo)向的抗腫瘤藥物臨床研發(fā)指導(dǎo)原則(征求意見稿)》(下稱指導(dǎo)原則),明確指出應(yīng)盡量為臨床試驗(yàn)對照組受試者提供臨床實(shí)踐中最佳治療方式/藥物,并且新藥研發(fā)應(yīng)以為患者提供更優(yōu)的治療選擇為最高目標(biāo)。此項(xiàng)政策在中國創(chuàng)新藥行業(yè)掀起了驚濤駭浪,深刻改變了國內(nèi)創(chuàng)新藥從立項(xiàng)到臨床的研發(fā)思路。
創(chuàng)新藥行業(yè)邏輯巨變
創(chuàng)新藥的顯著臨床價(jià)值是其較高商業(yè)價(jià)值的根基,以臨床價(jià)值為導(dǎo)向開展研發(fā)理應(yīng)成為行業(yè)共識,但是中國藥企和資本因過分急切追逐商業(yè)價(jià)值而偏離了這一理念。按照創(chuàng)新層級從低至高的順序,創(chuàng)新藥包括3類:me-too(同類相似)藥物是針對已確證的靶點(diǎn)和作用機(jī)制(已有藥物上市),規(guī)避已有藥物專利,研發(fā)具有不同分子結(jié)構(gòu)而療效相似的創(chuàng)新藥;me-better/best-in-class(同類更優(yōu)/最優(yōu))藥物是通過深入的研究和篩選,開發(fā)療效更優(yōu)或最優(yōu)的me-too藥物;first-in-class(同類首創(chuàng))是針對未確證靶點(diǎn)或老靶點(diǎn)新機(jī)制(未有藥物上市),研發(fā)具有全新分子結(jié)構(gòu)的藥物。
在2015年藥監(jiān)政策改革之前,政策、人才、技術(shù)、資本這4項(xiàng)創(chuàng)新生態(tài)要素均不具備,國內(nèi)罕有嚴(yán)格意義上的創(chuàng)新藥研發(fā)。2015年之后日漸完善的創(chuàng)新生態(tài)及仿制藥集采降價(jià)推動制藥行業(yè)轉(zhuǎn)向創(chuàng)新。多數(shù)藥企和資本選擇自主研發(fā)或授權(quán)引進(jìn)風(fēng)險(xiǎn)較低、研發(fā)較快的me-too藥物。在藥監(jiān)的加速審批程序之下,國產(chǎn)和進(jìn)口創(chuàng)新藥獲批數(shù)量均快速飆升,而其中大部分為me-too藥物。
圖表2. 已在中國獲批上市的me-too藥物
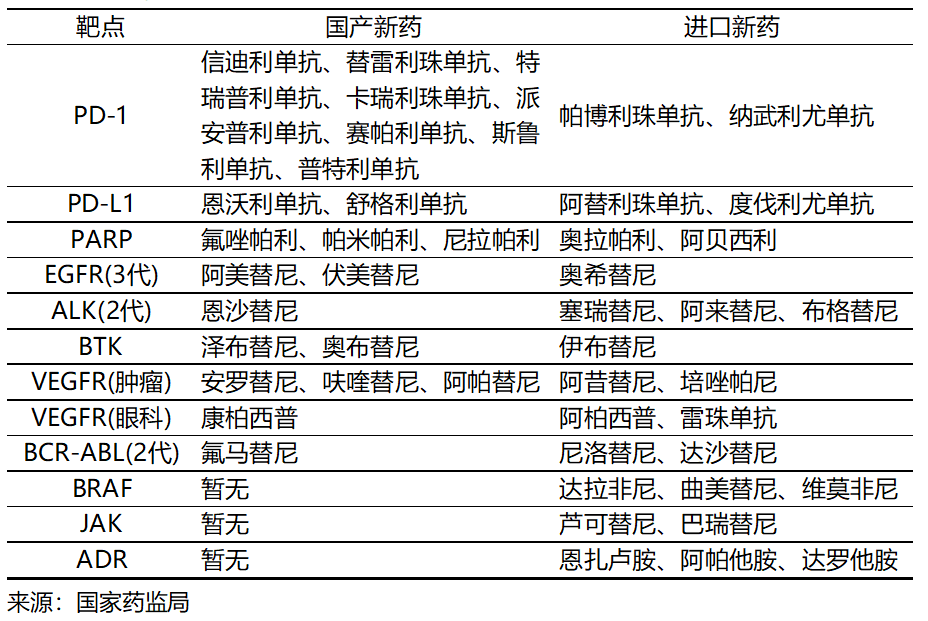
漸次獲批的國產(chǎn)和進(jìn)口me-too藥物,面臨以國家醫(yī)保談判為主的市場準(zhǔn)入,競相降價(jià)以搶占有限的市場空間。這客觀上改善了創(chuàng)新藥的可負(fù)擔(dān)性和可及性,有助于滿足臨床需求。然而,絡(luò)繹不絕的me-too藥物競爭有限的研發(fā)資源和市場空間,在推高成本的同時(shí)降低收益。按照風(fēng)險(xiǎn)與收益匹配原則,me-too藥物的較低風(fēng)險(xiǎn)理應(yīng)是較低收益,而不是部分藥企和資本預(yù)想的較高收益。Me-too藥物市場表現(xiàn)與預(yù)計(jì)的差距導(dǎo)致創(chuàng)新藥行業(yè)估值水平走低。
圖表3. 2016~2021年針對新藥和獨(dú)家品種的
國家藥品價(jià)格談判主要結(jié)果
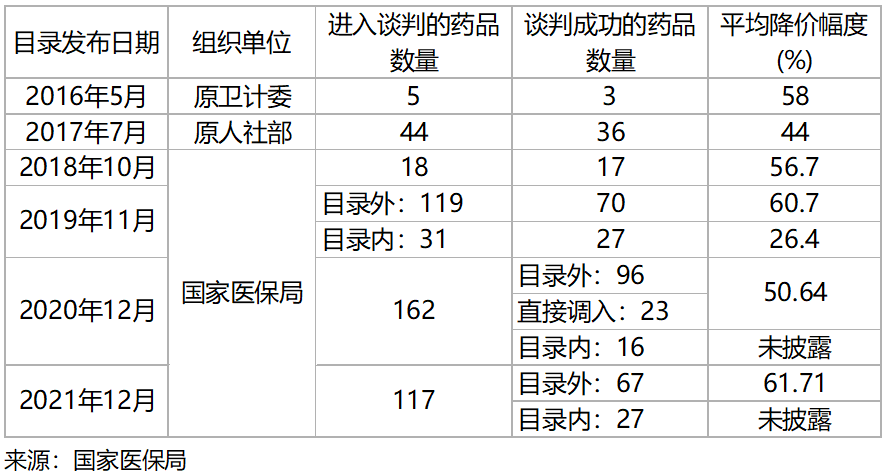
在創(chuàng)新收益不達(dá)預(yù)期的情況下,指導(dǎo)原則的發(fā)布更是火上澆油。指導(dǎo)原則要求臨床對照藥的優(yōu)先級順序?yàn)闃?biāo)準(zhǔn)治療、最佳支持治療、安慰劑。其中,標(biāo)準(zhǔn)治療指現(xiàn)階段證據(jù)表明的治療效果最佳的治療方案。優(yōu)先選擇標(biāo)準(zhǔn)治療作為對照藥是醫(yī)學(xué)倫理的合理要求,同時(shí)意味著較晚獲批的藥物比較早獲批的藥物具有更優(yōu)療效,即必須是me-better藥物、best-in-class藥物,或者first-in-class藥物。如果中國藥監(jiān)部門嚴(yán)格落實(shí)此項(xiàng)政策,那么me-too藥物未來將無法在中國獲批上市。美國FDA則嚴(yán)格落實(shí)對照藥必須為當(dāng)前標(biāo)準(zhǔn)治療的原則,并以此為重要理由在2022年先后拒絕批準(zhǔn)信達(dá)生物、百濟(jì)神州PD-1單抗的上市申請。國際化的重大挫折對于估值回調(diào)的創(chuàng)新藥行業(yè)無疑是雪上加霜。
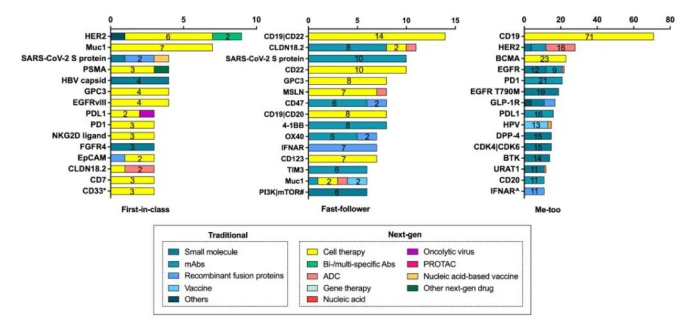
截至指導(dǎo)原則征求意見稿發(fā)布前日,中國在研me-too藥物大量扎堆,針對CD19、BCMA的細(xì)胞治療達(dá)到驚人的71個和23個,針對PD-1、PD-L1的單抗藥物分別有21個和16個,針對EGFR T790M的小分子藥物多達(dá)19個,針對HER2的ADC藥物多達(dá)16個,在研HPV疫苗有13個。在小分子化藥、單抗、疫苗、ADC等領(lǐng)域廣泛出現(xiàn)靶標(biāo)扎堆的現(xiàn)象,這顯示中國的me-too藥物進(jìn)入了“內(nèi)卷”時(shí)代。相比之下,first-in-class藥物的競爭則緩和許多。
圖表4. 中國所有在研新藥熱門靶標(biāo)TOP15
(截至2021.7.1)
醫(yī)藥行業(yè)進(jìn)入調(diào)整期
屋漏偏逢連陰雨,2021年下半年至2022年上半年的多起黑天鵝事件屢次打擊中國醫(yī)藥行業(yè)。2021年12月網(wǎng)絡(luò)傳聞美國無端誣陷BGI等中國生物技術(shù)公司非法獲取美國人的DNA信息并將用于軍事目的,呼吁將上述公司列入美國政府的貿(mào)易制裁實(shí)體清單。這導(dǎo)致中國A股和港股醫(yī)藥板塊全線閃崩。2022年2月,生物藥CDMO龍頭企業(yè)藥明生物被美國列入“未經(jīng)核實(shí)名單”,限制從美國進(jìn)口生物反應(yīng)器系統(tǒng)和過濾器等產(chǎn)品。這暴露了中國醫(yī)藥行業(yè)在上游的技術(shù)短板,導(dǎo)致商業(yè)模式完美、備受醫(yī)藥基金青睞的CXO板塊行情大跌。
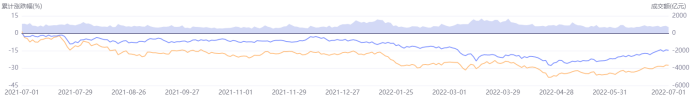
中國醫(yī)藥行業(yè)在疫情趨緩、創(chuàng)新藥國內(nèi)市場不達(dá)預(yù)期、國際化受挫、研發(fā)思路巨變、貿(mào)易限制等一系列利空因素之下,二級市場的表現(xiàn)從2021年7月開始下行,累計(jì)跌幅在2022年4月底最大近35%,隨后小幅上升至2022年7月的27%左右。在2021H2和2022H1的一年內(nèi),醫(yī)藥生物板塊始終跑輸滬深300指數(shù),在全行業(yè)增長中僅好于美容護(hù)理。曾經(jīng)的熱火朝天、花團(tuán)錦簇已經(jīng)不在,中國醫(yī)藥行業(yè)進(jìn)入了調(diào)整期。
圖表5. 近一年醫(yī)藥生物板塊與滬深300的走勢比較
(2021.7.1-2022.7.1)
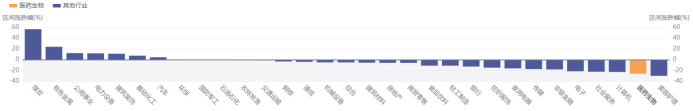
圖表6. 近一年醫(yī)藥生物板塊與其他行業(yè)的增長比較
(2021.7.1-2022.7.1)
因?yàn)橐詣?chuàng)新藥為代表的的行業(yè)邏輯變化,2022上半年中國醫(yī)療健康領(lǐng)域的投融資活動顯著減少,一級市場投融資事件數(shù)同比降低46.7%;IPO事件數(shù)同比降低45.5%;二級市場再融資事件數(shù)同比減少57.8%。在一級市場賽道中,創(chuàng)新藥領(lǐng)域的投融資事件數(shù)和金額仍居榜首,其中細(xì)胞治療、大分子創(chuàng)新藥居于前兩位。這反映出資本已經(jīng)在刻意回避me-too藥物研發(fā)集中的小分子化藥領(lǐng)域。
醫(yī)藥行業(yè)未來怎么辦
在“指導(dǎo)原則”征求意見稿于2021年7月發(fā)布后,做“真正創(chuàng)新”的創(chuàng)新藥(me-better/best-in-class),甚至向first-in-class藥物進(jìn)軍成為中國創(chuàng)新藥行業(yè)愈發(fā)清晰響亮的聲音。與此同時(shí),投資機(jī)構(gòu)紛紛對曾經(jīng)熱衷的me-too藥物和藥企自稱的me-better藥物棄如敝履。然而,落實(shí)到研發(fā)層面,藥企到底如何選擇?為此,北京E藥產(chǎn)業(yè)研究院聯(lián)合《E藥經(jīng)理人》雜志進(jìn)行了問卷調(diào)查。
圖表7. 中國制藥企業(yè)研發(fā)項(xiàng)目選擇調(diào)查結(jié)果
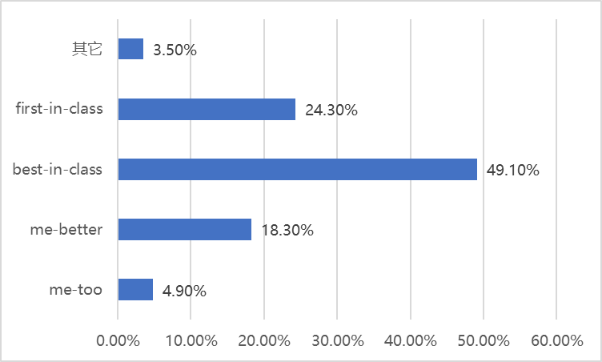
在635份問卷中,接近一半選擇best-in-class藥物進(jìn)行開發(fā),這與醫(yī)藥行業(yè)自媒體和會議論壇的主流聲音差別很大。選擇first-in-class、me-better、me-too的問卷依次減少,分別占24.3、18.3%、4.9%。由此可見,best-in-class藥物能夠較好均衡研發(fā)風(fēng)險(xiǎn)、融資難度、商業(yè)收益3大方面而成為優(yōu)選;生命科學(xué)基礎(chǔ)研究不足成為制約first-in-class藥物研發(fā)的瓶頸;me-too藥物則基本上已被拋棄。
2021年對中國創(chuàng)新藥行業(yè)來說是極不平凡的一年,創(chuàng)新藥全生命周期,從立項(xiàng)、研發(fā)到商業(yè)化的邏輯均發(fā)生了深刻的變化。一切過往,皆是序章。
聲明:本文系轉(zhuǎn)載內(nèi)容,版權(quán)歸原作者所有,轉(zhuǎn)載目的在于傳遞更多信息,并不代表我方觀點(diǎn)。如涉及作品內(nèi)容、版權(quán)和其它問題,請與我方留言聯(lián)系,我們將在第一時(shí)間刪除內(nèi)容。


