圖片來自Nature Nanotechnology, 2019, doi:10.1038/s41565-019-0485-z。
有限的納米藥物外滲到腫瘤組織中,升高的腫瘤間質液壓力,緊密堆積的腫瘤細胞和致密的細胞外基質阻止從血管周圍區域到遠端細胞的分子擴散。尺寸高達100 nm的納米藥物甚至受到更多限制。比如,阿霉素脂質體(Doxil,即聚乙二醇化的阿霉素脂質體)具有比游離的阿霉素更高的腫瘤內積聚,因而在外滲時嚴重受限于血管周圍區域,從而導致較低的療效。調整納米藥物的大小和其他性質可以在一定程度上改善腫瘤滲透;然而,由于體積龐大的納米藥物通過致密的細胞外基質借助腫瘤間質液壓力梯度進行的被動擴散保持不變,療效通常仍然較低。
在一項新的研究中,在受到內皮細胞穴樣內陷(caveolae)介導的轉胞吞作用(transcytosis)的啟發下,來自中國浙江大學、中國藥科大學、北京化工大學和美國加州大學洛杉磯分校的研究人員提出除了通過增強滲透和滯留效應進行納米藥物被動積聚外,內皮細胞轉胞吞作用可能會主動轉運納米藥物穿過毛細血管壁進入腫瘤組織。此外,這種依賴ATP的轉胞吞作用過程也可以繞過上面提及的被動擴散屏障,讓納米藥物在整個腫瘤中積極滲透,從而到達遠端細胞。
陽離子化可以有效地誘導吸附介導的轉胞吞作用并促進納米載體穿透多個細胞層。盡管陽離子電荷經常誘導調理作用和納米藥物從血液中快速清除,但是一種實現體內陽離子化觸發的納米藥物滲透到腫瘤中的有效策略是在含有管腔的內皮細胞表面上或者在進入腫瘤血管周圍之后,讓納米藥物陽離子化,同時在血液循環期間保持納米藥物中性或略帶陰離子。
雖然pH引發的電荷逆轉已被用來讓腫瘤中的納米藥物產生陽離子電荷,但是由于與管腔區室和血管周圍區室相關的生理中性pH的存在,這種效果通常也是有限的。即使對于這些腫瘤區域,略帶酸性的微環境通常與腫瘤血管網絡相距100–200 μm。
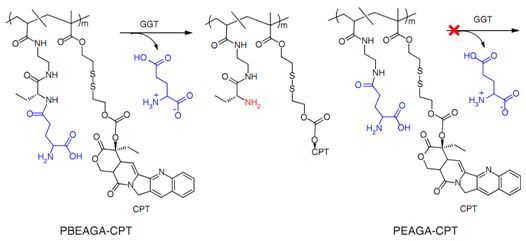
在各種人類腫瘤中,膜γ-谷氨酰轉肽酶(GGT)在內皮細胞的外表面上和位于血管周圍的代謝活躍的腫瘤細胞外表面中過表達。GGT切割γ-谷氨酰胺,因此已用于熒光探針和藥物前體的腫瘤特異性激活。
在這項新的研究中,這些研究人員展示了一種具有較長血液循環時間的兩性離子聚合物-藥物偶聯物(zwitterionic polymer–drug conjugate)。一旦接觸腫瘤內皮細胞或者外滲到與腫瘤細胞接觸的血管周圍區域,這種偶聯物遭受GGT介導的陽離子化,這就導致快速的穴樣內陷介導的內吞作用和轉胞吞作用,從而能夠發生跨內皮和跨細胞轉運,并且在整個腫瘤組織中相對均勻地擴散,因而顯著提高治療效果。相關研究結果近期發表在Nature Nanotechnology期刊上,論文標題為“Enzyme-activatable polymer–drug conjugate augments tumour penetration and treatment efficacy”。
這些研究人員證實GGT反應性陽離子化聚合物-藥物偶聯物(比如PBEAGA-CPT和PEAGA-CPT)通過癌細胞轉胞吞作用進行活躍地腫瘤滲透,從而實現增強的抗癌療效。特別地,GGT催化的PBEAGA-CPT陽離子化觸發內皮細胞的轉胞吞作用,從而導致癌細胞的快速外滲和有效的轉胞吞作用,并因而導致PBEAGA-CPT高效地進行腫瘤滲透。因此,PBEAGA-CPT能夠根除較大的大約500立方毫米的腫瘤,并且顯著地延長攜帶原位胰腺瘤的小鼠的存活期。
這種生物反應性藥物遞送策略可能經進一步擴展后用于設計基于生理信號治療多種疾病的治療性聚合物。(生物谷 Bioon.com)


